|
EL LCR EN ENFERMEDADES INFLAMATORIAS DEL SNC
SINDROME MENINGITIS--ARTERITIS QUE RESPONDE A CORTICOIDES:
La meningitis-arteritis que responde a corticoides es la causa de meningitis mûÀs frecuente en el paciente canino, siendo muy rara en la especie felina. No es una û¤nica entidad patolû°gica, sino que engloba a varios procesos, generalmente exudativos, y que tienen en comû¤n una respuesta favorable al tratamiento con corticosteroides. Algunos de ûˋstos sûÙndromes se definen por su patrû°n histopatolû°gico, su sintomatologûÙa, o su incidencia en algunas razas caninas, por lo que ha sido referido en numerosos estudios como meningitis que responde a esteroides, poliarteritis meningea, meningitis supurativa asûˋptica y sûÙndrome doloroso del Beagle.
Las lesiones patolû°gicas incluyen una degeneraciû°n fibrinoide y necrosis de la arteria meningea espinal con infiltraciû°n leucocitaria. Su etiologûÙa es desconocida, aunque se sospecha de un origen inmunomediado, con la probable implicaciû°n de algû¤n agente infeccioso no identificado.
Se presenta con mayor frecuencia en razas caninas grandes, con una elevada incidencia en el boxer. La edad de presentaciû°n es, por lo general, de 6 meses a 2 aûÝos; obteniûˋndose un pico de presentaciû°n en perros menores de 1 aûÝo. Aunque es raro, tambiûˋn pueden resultar afectados algunos perros gerontes.
Se presentan dos formas clûÙnicas: aguda y crû°nica. La forma aguda se caracteriza por signos clûÀsicos de meningitis con dolor espinal cervical, rigidez con ausencia de deficiencias neurolû°gicas y marcha rûÙgida con pasos cortos. En ocasiones, se observa hiperflexiû°n del cuello. La fiebre es comû¤n, y el paciente puede aparentar un dolor generalizado. Los signos clûÙnicos pueden aumentar o disminuir espontûÀneamente, lo que nos puede dar una impresiû°n errû°nea del ûˋxito del tratamiento. En ausencia de tratamiento, o con un tratamiento incorrecto, la enfermedad puede evolucionar a su forma crû°nica, caracterizada por el desarrollo de deficiencias neurolû°gicas con ataxias y paresias. Es probable, que por su presentaciû°n insidiosa, y sus signos clûÙnicos inespecûÙficos, la forma crû°nica estûˋ subdiagnosticada.
En las formas agudas, el anûÀlisis del LCR muestra una marcada pleocitosis con un RTCN superior a 100 cels/microL, aunque a menudo supera las 1.000 cels/microL. En ocasiones el LCR es claramente purulento con un aumento marcado de la viscosidad y turbidez. Los neutrû°filos suelen representar mûÀs del 80 % de las cûˋlulas observadas, presentûÀndose como no degenerados. No se observan bacterias, u otros organismos infecciosos en el estudio citolû°gico. Una cantidad variable de neutrû°filos presenta alteraciones morfolû°gicas premortem como pleocariocitosis (neutrû°filos ãviejosã con aumento del nû¤mero de lobulaciones nucleares), o picnosis. La concentraciû°n de proteûÙnas totales tambiûˋn estûÀ claramente incrementada. Debe tenerse en cuenta que en algunos casos agudos tempranos, el LCR puede ser normal, manifestûÀndose a corto plazo un aumento progresivo de la pleocitosis. En las formas crû°nicas, el LCR puede presentarse con leve a moderada pleocitosis; y la concentraciû°n de proteûÙnas, dentro de los parûÀmetros normales o ligeramente incrementadas.
En cuanto a los cambios hematolû°gicos observados con mayor frecuencia, se incluye una leve a moderada leucocitosis, con desviaciû°n a la izquierda, y un aumento de proteûÙnas plasmûÀticas a expensas de las globulinas. La IgA sûˋrica estûÀ a menudo aumentada.
El tratamiento empleado es la administraciû°n de corticosteroides a dosis inmunosupresoras. Se administra prednisona a dosis de 4 mg/kg diario los dos primeros dûÙas. Posteriormente, se disminuye la dosis a 2 mg/kg durante 2 semanas mûÀs. Finalmente, se reduce la dosis el 50 % cada dos semanas hasta llegar a 0,5 mg/kg, manteniûˋndose con ûˋsta posologûÙa durante 6 meses. En la mayorûÙa de los casos, se observa una remisiû°n de la sintomatologûÙa y el dolor, varios dûÙas tras el inicio del tratamiento, y una rûÀpida disminuciû°n de la pleocitosis en el LCR. Es importante continuar con el tratamiento durante los prû°ximos meses con el objeto de evitar recaûÙdas.
El pronû°stico es generalmente bueno en los casos agudos, sobretodo en los que se ha aplicado el tratamiento en fases tempranas, aunque las recaidas pueden ser frecuentes. En los casos crû°nicos, el pronû°stico es reservado y es dependiente de la reversibilidad de las deficiencias neurolû°gicas presentes.
MENINGOENCEFALITIS GRANULOMATOSA (MEG):
La meningoencefalitis granulomatosa (MEG) canina, es un desorden idiopûÀtico de apariciû°n aguda y progresiva. Es, probablemente, tras el moquillo la enfermedad inflamatoria del SNC mûÀs frecuente en el paciente canino. La enfermedad afecta a perros de todas las razas, edades y sexos; aunque segû¤n diversos estudios, se ha observado una elevada incidencia en perros adultos jû°venes de 1 a 6 aûÝos de edad y de razas pequeûÝas; especialmente caniches y terriers. Otros estudios, no han demostrado tal predilecciû°n racial.
Su etiologûÙa es desconocida, aunque muchos autores consideran que la causa mûÀs probable es un virus. No se han encontrado evidencias de antûÙgenos virales en los tejidos investigados, y los patrones histopatolû°gicos de las lesiones por moquillo y por MEG estûÀn claramente diferenciados. El sûÙndrome se caracteriza por sus manifestaciones patolû°gicas. El patrû°n histolû°gico caracterûÙstico es un acû¤mulo de cûˋlulas inflamatorias ordenadas ãen remolinoã alrededor de los vasos sanguûÙneos. Desde el punto de vista anatomopatolû°gico se encuentran dos formas de MEG: local y diseminada. La forma focal se presenta como una masa granulomatosa, con frecuencia localizada en la sustancia blanca cerebral o en el tronco encefûÀlico. En la forma diseminada, las lesiones estûÀn distribuidas a lo largo de todo el SNC; aunque se presentan, fundamentalmente, en la sustancia blanca del cerebro, cerebelo, parte caudal del tronco encefûÀlico y segmentos cervicales de la mûˋdula espinal.
Los perros con la forma diseminada presentan, por lo general, un curso agudo con progresiû°n rûÀpida, y la muerte sobreviene de 1-3 semanas tras la apariciû°n de los sûÙntomas. La forma focal tiene un inicio mûÀs insidioso con progresiû°n lenta de 3-6 meses. La sintomatologûÙa en la MEG es variable, con dolor cervical, ataxia o parexia. Otros signos menos comunes pueden ser ceguera, disfunciû°n vestibular, convulsiones o marcha circular. AdemûÀs, la foma diseminada puede manifestar signos sistûˋmicos con fiebre y signos gastrointestinales.
El diagnû°stico se basa en la sintomatologûÙa, el anûÀlisis del LCR, la exclusiû°n de meningitis infecciosas y la imagenologûÙa con TAC o RM. Empleando la RM es comû¤n encontrar en la forma focal una masa en la sustancia blanca, que realza con contraste. Estas lesiones son indiferenciables de masas tumorales o infarto, aunque permiten su localizaciû°n para realizar una posible biopsia.
Los cambios en el LCR son variables, aunque en general, puede encontrarse una pleocitosis de leve a marcada, caracterizada por un predominio de linfocitos, un 0-20 % de polimorfonucleares y un 0-20 % de monocitos/macrû°fagos. Tambiûˋn puede observarse algunas cûˋlulas plasmûÀticas y cûˋlulas mononucleares grandes y anaplûÀsicas. Aunque en la mayorûÙa de casos se observa una pleocitosis linfocûÙtica, en muchas ocasiones podemos obtener un patrû°n mixto con aproximadamente un 50 % de polimorfonucleares y un 50 % de mononucleares, aunque es raro que los neutrû°filos superen el 50 %. En un estudio, se observû° que el 10-15 % de los perros con MEG tenûÙan un LCR normal. Aproximadamente, el mismo porcentaje se obtuvo para aquellos casos con un RTCN superior a 1.000 cels/microL. La concentraciû°n de proteûÙnas se halla aumentada de forma leve a moderada en la mayorûÙa de los casos, aunque en algunos pacientes pueden encontrarse aumentos muy marcados superiores a 1.000 mg/dL.
El diagnû°stico del MEG presenta un importante reto diagnû°stico debido a la gran variabilidad de patrones observados en el LCR. Debe realizarse un diagnû°stico diferencial con el virus del moquillo, ya que la encefalitis por moquillo suele caracterizarse tûÙpicamente por una pleocitosis linfocûÙtica leve, es por ello que los casos de MEG que manifiestan una leve pleocitosis no pueden diferenciarse del moquillo por el anûÀlisis de rutina del LCR. El diagnû°stico definitivo se obtiene mediante estudio histopatolû°gico de las muestras obtenidas mediante biopsia o necropsia.
El tratamiento consiste en la administraciû°n de prednisona a dosis de 1-2 mg/kg diariamente, hasta la remisiû°n de la sintomatologûÙa. Posteriormente, ir reduciendo la dosis gradualmente hasta establecer la dosis mûÙnima efectiva. Si la respuesta inmunodepresora de la corticoterapia es incompleta, o se desea reducir la dosis de prednisona, pueden emplearse otras drogas inmunodepresoras como la azatioprina. Otra alternativa es la utilizaciû°n de radioterapia que ha demostrado su efectividad en algunos pacientes, por lo que puede ser utilizada en aquellos casos refractarios a la medicaciû°n.
El pronû°stico es reservado, ya que a pesar de que la mayorûÙa de los pacientes mejoran con la terapia, en numerosos casos se producen recidivas.
MENINGOENCEFALITIS NECROTIZANTE DEL PERRO PUG:
Es una forma de encefalitis no supurativa que afecta a perros Pug, Malteses y Yorkshire terriers. Desde el punto de vista histopatolû°gico, se observa una meningoencefalitis necrotizante no supurativa y con predilecciû°n casi exclusiva por el cerebro. En algunas zonas del cerebro, puede haber zonas de necrosis sin inflamaciû°n, lo que sugiere que la necrosis es la lesiû°n primaria.
Su etiologûÙa es desconocida. La predisposiciû°n racial y el hecho de que muchos pacientes afectados presenten una lûÙnea filogenûˋtica comû¤n, sugiere la presencia de algû¤n componente genûˋtico. Los hallazgos histopatolû°gicos apuntan a la posibilidad de implicaciû°n de algû¤n agente infeccioso no identificado. Cabe la posibilidad de que un agente infeccioso, probablemente un virus, desencadene una respuesta inmune exagerada en pacientes genûˋticamente predispuestos.
La edad de presentaciû°n es entre los 6 meses de edad y los 7 aûÝos, aunque hay una mayor predisposiciû°n en los perros jû°venes. La enfermedad puede tener un curso agudo o un curso crû°nico. En la forma aguda se presentan, generalmente, convulsiones, marcha circular, ataxia, en ocasiones ceguera, o dolor cervical y casi siempre con conductas anormales. No suele observarse sintomatologûÙa vestibular o medular. La enfermedad progresa durante 1 o 2 semanas hasta el coma. En la forma crû°nica, es muy frecuente la presencia de convulsiones recurrentes, no presentando en un principio deficiencias neurolû°gicas, pero progresando al cabo de 4 a 6 semanas a un estado disfuncional del cerebro, con los mismos signos observados en los casos agudos: letargia, ataxia, ceguera, caminata en cûÙrculos, etc.
El diagnû°stico se realiza por las caracterûÙsticas clûÙnicas y los datos de laboratorio en animales predispuestos. No se encuentran, por lo general, alteraciones hematolû°gicas, ni en la quûÙmica sûˋrica, pero el anûÀlisis de LCR muestra algunas alteraciones. En un estudio, Cordly y Holliday, en el que analizaron el LCR de 12 perros con meningoencefalitis necrotizante, observaron en la mayorûÙa de los casos, una pleocitosis linfocûÙtica moderada a marcada con recuentos entre 70 ã 600 cels/microL y un 80 % o mûÀs de linfocitos. Las proteûÙnas totales tambiûˋn estaban elevadas, con cifras entre 60 ã 200 mg/dl. Posteriormente, otros autores han encontrado hallazgos similares.
El tratamiento con corticosteroides (prednisona a dosis inmunodepresoras) mejora temporalmente a los animales afectados, aunque se considera de mal pronû°stico, ya que es una enfermedad progresiva. No existe terapia especûÙfica efectiva.
VASCULITIS MENINGEA:
Es un proceso bastante infrecuente, afectando mayoritariamente a animales menores de 1 aûÝo. Se ha observado en animales de la misma camada, por lo que se ha sugerido la existencia de una predisposiciû°n genûˋtica. Los signos clûÙnicos observados, son muy similares a las de cualquier meningitis. El patrû°n hestopatolû°gico es muy caracterûÙstico, presentando lesiones vasculares inflmatorias con degeneraciû°n fibrinoide de la pared vascular. Se sospecha de una etiologûÙa inmunomediada, ya que no ha sido aislado hasta la fecha ningû¤n agente infeccioso, y muchos pacientes responden al tratamiento con corticoterapia. AdemûÀs, en humanos, hay un proceso inmunomediado similar que presenta lesiones microscû°picas similares.
El LCR presenta tûÙpicamente una marcada pleocitosis neutrofûÙlica, en ocasiones superando las 1.000 cels/microL, con neutrû°filos no degenerados (aprox. 70-95 % del total de cûˋlulas). Las concentraciones de proteûÙnas estûÀn, por lo general, moderadamente incrementadas.
ENFERMEDADES VIRALES:
1 - Virus del moquillo canino:
El agente causal de moquillo es un Morbillivirus, de la familia Paramixoviridae. El empleo sistemûÀtico de vacunas ha reducido en gran medida la incidencia de la enfermedad, aunque son frecuentes los casos en perros no vacunados, y no son raros los casos de encefalomielitis en perros adultos vacunados. Los perros con una respuesta inmune temprana y efectiva, se recuperan con signos clûÙnicos leves o sin sintomatologûÙa.
Actualmente, se consideran 3 formas clûÙnicas de encefalitis producida por moquillo: Encefalitis aguda, encefalomielitis crû°nica y encefalitis del perro geronte.
Encefalitis aguda: se presenta en perros jû°venes inmunolû°gicamente inmaduros, o en adultos con un sistema inmune desarrollado, pero incapaces de desarrollar una respuesta inmune temprana. La enfermedad se caracteriza por la presencia de signos sistûˋmicos de curso agudo con tos, vû°mitos, diarreas, secreciû°n nasal, conjuntivitis y en algunos casos hiperqueratosis plantar. Los signos neurolû°gicos pueden presentarse durante o despuûˋs de la enfermedad sistûˋmica. Se presentan crisis cerebrales caracterûÙsticas (ãmascar chicleã) y otras conductas anormales.
Encefalomielitis crû°nica: en perros inmunolû°gicamente maduros que desarrollan una respuesta inmune tardûÙa, puede desarrollarse una encefalomielitis crû°nica y persistente, con signos sistûˋmicos ausentes o leves. Puede presentarse en animales vacunados. Se producen lesiones inflamatorias multifocales en la sustancia blanca del tronco encefûÀlico y mûˋdula espinal. Estos pacientes presentan, a menudo, deficiencias progresivas en la marcha, disfunciû°n vestibular o mioclonias (sobretodo en mû¤sculos de la cabeza o miembros).
Encefalitis del perro geronte: Es una forma de moquillo muy rara. Se presenta en perros mayores de 6 aûÝos y cursa con demencia progresiva, alteraciones en la marcha, ataxia y ceguera progresiva. No son tûÙpicas las parûÀlisis o convulsiones; y la enfermedad se desarrolla sin signos sistûˋmicos. La histopatologûÙa del SNC, se caracteriza por un patrû°n inflamatorio difuso y degeneraciû°n de las sustancias gris y blanca del cerebro y del tronco encefûÀlico.
El diagnû°stico de moquillo agudo en cachorros, es con frecuencia, relativamente fûÀcil por los signos sistûˋmicos y neurolû°gicos que presentan. El dato hematolû°gico mûÀs frecuente es la linfopenia, ya que el virus es linfotrû°pico. Esta es la razû°n por la que, junto a un sistema inmune poco desarrollado, los animales infectados produzcan niveles inadecuados de inmunoglobulinas especûÙficas contra el virus del moquûÙllo, y por lo tanto, las tûˋcnicas serolû°gicas indirectas, sean con frecuencia negativas (falsos negativos). En ocasiones se presenta tambiûˋn trombocitopenia y monocitosis. En algunos cachorros con el proceso agudo, pueden identificarse cuerpos de inclusiû°n del virus del moquillo (corpû¤sculos de Lentz) en las cûˋlulas sanguûÙneas. Su presencia es diagnû°stica de la infecciû°n, apareciendo como formas esfûˋricas u ovoides en los hematûÙes o citoplasma de los leucocitos, durante las fases tempranas de la enfermedad; aunque habitualmente, desaparecen al inicio de los sûÙntomas.
La forma crû°nica es mûÀs difûÙcil diagnû°sticar, ya que habitualmente no estûÀn presentes los signos sistûˋmicos tûÙpicos, y la serologûÙa es difûÙcil de interpretar. Los perros maduros inmunocompetentes con encefalomielitis por moquillo, suelen tener anticuerpos circulantes, aunque con frecuencia son perros vacunados, y las tûˋcnicas serolû°gicas actuales no permiten distinguir anticuerpos vacunales de los producidos por la infecciû°n natural. La particularidades del diagnû°stico serolû°gico del moquillo, y su interpretaciû°n, ya han sido expuestas en el capûÙtulo de anûÀlisis inmunolû°gico del LCR.
El protocolo utilizado en nuestro hospital es la determinaciû°n de IgG e IgM sûˋricos (o del LCR) en animales adultos no vacunados e inmunocompetentes con sospecha de encefalomielitis por moquillo. En los pacientes vacunados (o con sospecha de vacunaciones previas) realizamos una PCR del LCR. Una PCR positiva es diagnû°stica de la enfermedad, pero una PCR negativa no la excluye, ya que sû°lo pueden evidenciarse partûÙculas vûÙricas en el 80 % de los pacientes infectados y con signos neurolû°gicos. En los cachorros con sospecha de forma aguda, y con sintomatologûÙa poco clara, puede realizarse una PCR de sangre, orina o frotis farûÙngeo. No es recomendable realizar pruebas serolû°gicas indirectas en animales inmunodeprimidos o con un sistema inmune inmaduro.
El anûÀlisis de rutina del LCR es un procedimiento de gran ayuda que puede aportar valiosa informaciû°n, aunque los resultados obtenidos no son especûÙficos de la infecciû°n. En fases tempranas de la forma aguda de la enfermedad, no suelen manifestarse alteraciones en el RTCN y proteûÙnas totales del LCR, aunque si estûÀn plenamente establecidos los signos neurolû°gicos, puede observarse una leve pleocitosis neutrofûÙlica o mixta, un ligero incremento de proteûÙnas con un indice IgG normal. En la forma crû°nica, se observa tipicamente una leve o moderada pleocitosis linfocûÙtica (con frecuencia un RTCN < 25 cels/microL). En aquellos casos en los que estûÀ presente una encefalomalacia asociada, se puede manifestar una pleocitosis mûÀs elevada con desviaciû°n hacia la forma neutrofûÙlica. Las proteûÙnas totales estûÀn, por lo general, muy levemente aumentadas, no sobrepasando los 50 mg/dL. Es muy infrecuente observar cuerpos de inclusiû°n en la citologûÙa del LCR, aunque su presencia es diagnû°stica de la enfermedad.
El empleo de TAC o Resonancia Magnûˋtica, son otros procedimientos diagnû°sticos de gran utilidad, ya que a menudo, permiten visualizar las lesiones multifocales caracterûÙsticas en el tronco encefûÀlico y mûˋdula espinal.
No hay un tratamiento especûÙfico, por lo que debe emplearse una terapia sintomûÀtica con antibiû°ticos de amplio espectro y dosis antiinflamatorias de corticoides (1 mg/kg de prednisolona diariamente durante 7 a 10 dûÙas). Los cachorros con sintomatologûÙa sistûˋmica y neurolû°gica graves tienen un pronû°stico malo. Los adultos con la forma crû°nica en ocasiones se recuperan, por lo se debe intentar el tratamiento. La parûÀlisis o convulsiones son signos de mal pronû°stico.
2 - Peritonitis infecciosa felina (PIF):
La peritonitis infecciosa felina es una enfermedad producida por la respuesta inmunomediada por un coronavirus. Afecta fundamentalmente a gatitos de menos de 1 aûÝo de edad, aunque puede desarrollarse a cualquier edad. Aunque la entrada del virus puede producirse por otros mecanismos, la infecciû°n se produce fundamentalmente por la ingestiû°n de alimentos o fû°mites contaminados.
Existen 2 formas de la enfermedad: forma seca o parenquimatosa y forma hû¤meda o efusiva. La sistomatologûÙa nerviosa estûÀ asociada, por lo general, con la forma parenquimatosa, que se caracteriza por una respuesta inmune celular parcial y una fuerte respuesta humoral. Utilizando tûˋcnicas inmunohistoquûÙmicas, se pueden evidenciar depû°sitos de inmunocomplejos alrededor de los vasos sanguûÙneos (vasculitis y perivasculitis). La lesiû°n caracterûÙstica es una inflamaciû°n piogranulomatosa difusa que se extiende por el plexo coroideo, meninges, epûˋndimo y perûˋnquima del tronco encefûÀlico y mûˋdula espinal.
A pesar de que se trata de una lesiû°n difusa, los signos neurolû°gicos observados son, a menudo compatibles con una lesiû°n focal, e incluyen desde una leve alteraciû°n de la conciencia, hasta sûÙndrome vestibular y convulsiones. La anormalidad neurolû°gica mûÀs frecuente es la parûÀlisis del tren posterior. Muchos de los gatos afectados tienen sintomatologûÙa sistûˋmica con pûˋrdida de peso y uveûÙtis.
Las anormalidades mûÀs destacadas en el anûÀlisis de sangre son hiperglobulinemia (una relaciû°n albû¤mina/globulina < de 0.4 es muy indicativa de PIF, mientras que valores > 0.8 permiten descartarlo), anemia no regenerativa leve a moderada, leucocitosis neutrofûÙlica con desviaciû°n a la izquierda y linfopenia. Puede ser û¤til realizar una determinaciû°n de la glucoproteûÙna ûÀcida (AGP) sûˋrica, ya que valores superiores a 1.500 microg/mL son muy indicativos de PIF en ausencia de peritonitis o pleuritis bacterianas. En la actualidad, no se dispone de pruebas serolû°gicas confiables que permitan diagnosticar la enfermedad. Las tûˋcnicas de PCR en tiempo real (RT-PCR) en sangre, permiten la detecciû°n del coronavirus, pero no dicriminan los animales enfermos de los sanos infectados con cepas no patû°genas. La PCR a partir del LCR de animales con signos neurolû°gicos es mûÀs especûÙfica, aunque de baja sensibilidad. En un estudio realizado en gatos con PIF neurolû°gica se determinû° sû°lo 1 caso de cada 3 como positivo para PIF por la tûˋcnica de PCR a partir de LCR.
El estudio del LCR puede ofrecer valiosa infomaciû°n. A pesar de que muchas enfermedades vûÙricas con afectaciû°n neurolû°gica producen un patrû°n de pleocitosis mononuclear, en el PIF se observa una importante exudaciû°n neutrofûÙlica. El patrû°n observado es, por lo tanto, de una moderada a marcada pleocitosis mixta (con RTCN de 100-1.000 cûˋlulas/microL), con una destacada presencia de cûˋlulas mononucleares y neutrû°filos. La concentraciû°n de proteûÙnas totales estûÀ, generalmente, bastante incrementada, encontrando usualmente valores por encima de los 200 mg/dL, permitiendo diferenciar el PIF de otras causas de meningoencefalitis que no causan aumentos tan pronunciados de proteûÙnas.
La RM muestra con frecuencia un realce en secuencia T2 y a nivel del tronco encefûÀlico del revestimiento ventricular, plexo coroideo y meninges.
El PIF esta considerada una enfermedad de mal pronû°stico, ya que los animales clûÙnicamente enfermos mueren invariablemente. No existe en la actualidad un tratamiento efectivo, aunque en los casos leves la administraciû°n de inmunodepresores y antiinflamatorios, puede mejorar la calidad de vida durante varios meses.
3 - Rabia:
La rabia es una enfermedad zoonû°tica de gran importancia para la salud pû¤blica, producida por un lissavirus (familia Rhabdoviridae) y distribuida en todo el mundo, salvo unas pocas regiones. La enfermedad causa una encefalomielitis aguda. Las lesiones histopatolû°gicas se caracterizan por infiltraciû°n de cûˋlulas mononucleares perivasculares, astrocitosis y degeneraciû°n neuronal en la sustancia gris del tronco encefûÀlico y el hipocampo.
La rabia debe incluirse en los diagnû°sticos diferenciales en animales con enfermedad neurolû°gica aguda de rûÀpida progresiû°n procedentes de ûÀreas endûˋmicas. No hay alteraciones tûÙpicas en la hematologûÙa o en la bioquûÙmica. Aunque no hay muchas publicaciones que describan los cambios observados en el LCR, se considera, por lo comû¤n como normal, o con una leve pleocitosis linfocûÙtica. La concentraciû°n de proteûÙnas se establece como normal en la mayorûÙa de los casos.
MENINGITIS BACTERIANAS:
En condiciones normales, el LCR es asûˋptico. Las infecciones bacterianas del SNC son muy raras en perros y gatos, en comparaciû°n a la elevada frecuencia observada en humanos. Las vûÙas de entrada de los microorganismos son por diseminaciû°n local de infecciones prû°ximas al SNC, o por difusiû°n hematû°gena de un foco sûˋptico a partir de ûÀreas alejadas. Las infecciones bacterianas graves de de los cornetes nasales, o las otitis internas pueden ser, por su proximidad, causantes de meningitis bacterianas. Los focos alejados, que pueden producir meningitis sûˋptica, son las endocarditis bacterianas, infecciones del tracto urinario, prostatitis y piometra. Diversos estudios seûÝalan que las bacterias aisladas con mayor frecuencia en el LCR canino son de los gûˋneros Staphylococcus, Pasteurella, enterobacterias como E. coli y Klebsiella; y otras bacterias superiores como Nocardia y Actinomyces.
La sintomatologûÙa de la meningitis bacteriana depende de la respuesta inmune del huesped, de modo que la liberaciû°n de citoquinas e interleucinas, ocasiona una alteraciû°n en la barrera hematoencefûÀlica, aumentando la presiû°n intracraneal. En aquellos casos en los que la infecciû°n invade el parenquima del SNC se produce una mielitis o encefalitis bacteriana.
Los sûÙntomas clûÙnicos son con frecuencia agudos y de progresiû°n rûÀpida, con rigidez cervical y fiebre. Algunos casos presentan una historia reciente de infecciû°n urinaria, otitis o trauma craneal. En la fase inicial no se presentan deficiencias neurolû°gicas, pero si progresa la enfermedad sin tratamiento pueden manifestarse convulsiones, parûÀlisis, nistagmo o ceguera. El aumento de la presiû°n intracraneal puede causar opistotonos con hiperextensiû°n de la cabeza, tetraparesia, anisocoria y alteracion progresiva de la conciencia.
Con frecuencia no se observan alteraciones en el hemograma, aunque puede mostrarse una leve a moderada leucocitosis con desviaciû°n a la izquierda. El diagnû°stico se efectû¤a con el anûÀlisis del LCR. El LCR se presenta, frecuentemente muy turbio, mostrando una marcada pleocitois neutrofûÙlica con un RTCN generalmente superior a las 1.000 cels/microL. En fases iniciales es caracterûÙstico encontrar un 80 % de neutrû°filos en el diferencial leucocitario, aunque algunos autores han seûÝalado que en fases avanzadas de la enfermedad puede producirse una desviaciû°n linfocitaria. Las proteûÙnas totales suelen estar marcadamente aumentadas. Con respecto al estudio citolû°gico, la evidencia de bacterias fagocitadas es diagnû°stico de la infecciû°n bacteriana. La identificaciû°n de neutrû°filos degenerados es muy sugestivo de infecciû°n, con implicaciû°n de bacterias G(-) o algunas cepas de Staphylococcus, permitiendo sospechar una causa infecciosa por encima de otras etiologias, como meningitis que responde a corticoides.
El aislamiento de microorganismos en las meningitis bacterianas en el perro y el gato, es mûÀs difûÙcil que en el hombre. Se ha postulado que los falsos negativos obtenidos en los cultivos del LCR caninos y felinos pueden estar ocasionados por diversos motivos, como una menor presencia de carga bacteriana en las meningitis animales, la presencia de inhibidores de crecimiento bacteriano y, finalmente, una mala praxis durante la extracciû°n, transporte y manejo de las muestras en el laboratorio. A pesar de todo, ante la sospecha de meningitis de origen bacteriano, es recomendable la realizaciû°n de cultivos para aerobios y anaerobios, y en caso de crecimiento realizar un antibiograma.
La meningitis bacteriana es una patologûÙa que requiere un tratamiento urgente, por lo que es necesario aplicar antibioterapia de amplio espectro antes de conocer el resultado del antibiograma, que puede demorarse mûÀs de 2 dûÙas desde el envûÙo de las muestras. El tratamiento inicial depende de la observaciû°n citolû°gica. Si se observan formas cocoides fagocitadas y prûÀctica ausencia de degeneraciû°n neutrofûÙlica, se administra un antibiû°tico de amplio espectro para G (+) como ampicilina (10 mg/kg IV cada 6 horas). Si se observa degeneraciû°n neutrofûÙlica y/o bacilos bipolares fagocitados, se administrarûÀ una fluoroquinolona como enrofloxacina (5-10 mg/kg IM SID), o cefotaxima (20 mg/kg IV, cada 6 horas). El tratamiento se modificarûÀ en funciû°n de los resultados del antibiograma y de la respuesta del paciente a la terapia. Una û¤nica dosis de dexametasona (0,1-0,2 mg/kg IM) puede ayudar a disminuir los efectos daûÝinos de la inflamaciû°n. Si el paciente presenta signos de aumento de la presiû°n intracraneal se administrarûÀ manitol (1 gr/kg intravenoso).
Si el tratamiento es correcto, se observarûÀ una clara mejorûÙa en los prû°ximos dûÙas. Debe continuarse la administraciû°n del antibiû°tico hasta 2 semanas tras la desapariciû°n total de los sûÙntomas para evitar recaûÙdas. El pronû°stico es reservado en funciû°n del desarrollo o no de anormalidades neurolû°gicas irreversibles.
MENINGITIS FUNGICAS:
Los agentes micû°ticos que afectan otras ûÀreas corporales, pueden en ocasiones, afectar el SNC ocasionando meningitis fû¤ngicas. Aunque pueden estar implicados otros hongos, los microorganismos mûÀs frecuentemente aislados en el LCR son Cryptococcus neoformans y Coccidioides inmitis.
1 - Criptococosis:
Es el hongo que se aisla con mayor frecuencia en el LCR del perro y el gato. Es un organismo cosmopolita, aislandose en gran nû¤mero en las heces de palomas. La vûÙa de entrada es por inhalaciû°n de hongos suspendidos en el aire. Tienen predilecciû°n por el SNC, al que acceden via hematû°gena, o quizûÀs mûÀs frecuentemente, a travûˋs de los cornetes nasales. La capacidad infectiva del Cryptococcus depende de la situaciû°n inmune del animal, aunque han sido descrito casos en animales inmunocompetentes.
En los gatos se produce una leve meningitis no supurativa, mientras que los perros desarrollan una respuesta mûÀs celular con reacciû°n granulomatosa en el cerebro y meninges. Los sûÙntomas mûÀs comunmente observados son alteraciones en la conducta, debilidad, convulsiones y ceguera; aunque muchos animales desarrollan lesiones en otros û°rganos. El curso de la enfermedad puede ser agudo o crû°nico, siendo fatal si no se administra un tratamiento adecuado.
El hemograma y la bioquûÙmica sûˋrica pueden ser normales. El diagnû°stico se establece por la clûÙnica, serologûÙa, cultivo o identificaciû°n del organismo. La prueba laboratorial de detecciû°n de antûÙgeno criptocû°cico en lûÀtex (LCAT) permite la detecciû°n de un antûÙgeno capsular del hongo en diferentes lûÙquidos orgûÀnicos. El LCR presenta, tûÙpicamente, una pleocitosis marcada con predominio de neutrû°filos (> del 60 %), aunque tambiûˋn ha sido descrita una pleocitosis eosinofûÙlica con mûÀs del 80 % de eosinû°filos. Asimismo, se presenta un aumento marcado de proteûÙnas totales. Las levaduras de cryptococcus se observan en aproximadamente el 60 % de los pacientes afectados y su identificaciû°n microscû°pica es diagnû°stica del proceso.
Las esfûˋrulas caracterûÙsticas de Cryptococcus neoformans son de unos 3-8 micras de diûÀmetro. Contienen una cû psula bastante gruesa que impide el paso de tinta china al interior del parûÀsito. Esta cualidad sirve para la identificaciû°n del parûÀsito, ya que ofrecen una imagen negativa al utilizar tinta china como tûˋcnica de tinciû°n.
En la resonanacia magnûˋtica los granulomas criptocû°cicos se observan como estructuras hipointensas en secuencia T1, hiperintensas en T2 con realce al administrar contraste.
El tratamiento se basa en la administraciû°n de fluconazol a dosis de 5-15 mg/kg, vûÙa oral, 2 veces diarias. Algunos autores consideran que la administraciû°n del antifû¤ngico debe continuarse hasta que los valores de antûÙgenos sûˋricos no disminuyan hasta al menos 2 û°rdenes en magnitud. De cualquier modo es recomendable seguir con el trataminento durante al menos un mes tras la resoluciû°n de los signos clûÙnicos. En algunos pacientes la administraciû°n de antifû¤ngicos puede exacerbar los sûÙntomas durante los primeros dûÙas. El empleo de prednisona a dosis antiinflamatorias (0,5 mg/kg y dûÙa) durante 3 o 4 dûÙas, puede ayudar a minimizar tales efectos. En situaciones con aumentos de la presiû°n intracraneal se administrarûÀ manitol a dosis de 1 gr/kg, intravenoso.
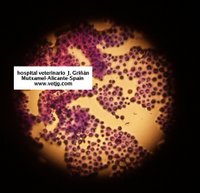

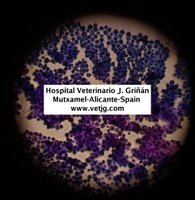
imûÀgenes de criptococos en un LCR de un perro con meningoencefalitis (tinciû°n Diff-Quick)
2 - Coccidioidomicosis:
Producida por Coccidioides inmitis, microorganismo telû¤rico que se encuentra casi exclusivamente en centroamûˋrica y sudamûˋrica. Al igual que el Criptococcus, ingresa en el organismo por la inhalaciû°n de artrosporas. Tiene predilecciû°n por el tejido pulmonar, aunque en infecciones masivas puede verse implicado el SNC. Existe una predisposiciû°n en perros de raza grande y menores de 5 aûÝos de edad.
Los signos pulmonares a menudo son leves y cursan con fiebre, tos, disnea y letargia; aunque son numerosos los perros con infecciû°n latente y sin sintomatologûÙa respiratoria. Muchos animales con diseminaciû°n neural no presentan alteraciones respiratorias recientes en su historia clûÙnica. Los sûÙntomas nerviosos incluyen convulsiones, ataxia, alteraciones vestibulares y en casos extremos coma.
Los signos laboratoriales son inespecûÙficos, e incluyen leucocitosis, azotemia y proteinuria, reflejando la alteraciû°n sistûˋmica. El anûÀlisis del LCR refleja un patrû°n de meningitis similar al encontrado en las infecctiones criptocû°cicas, con pleocitosis neutrofûÙlica de leve a marcada, e hiperproteinorraquia marcada. El diagnû°stico definitivo se establece mediante la observaciû°n directa del microorganismo en estudios citolû°gicos del LCR, aunque es una prueba de baja sensibilidad. El microorganismo puede adoptar diferentes morfologûÙas, siendo caracterûÙsticas las esfûˋrulas de gran tamaûÝo (20-200 micras), con endosporas de unas 2-5 micras en su interior. Otra posibilidad diagnû°stica es mediante cultivo del microorganismo en medios Sabouraud y posterior identificaciû°n. Existen en la actualidad, numerosas pruebas inmunolû°gicas que pueden aportar valiosa informaciû°n para su diagnû°stico. Una de las mûÀs importantes es la valoraciû°n del tûÙtulo de anticuerpos mediante fijaciû°n de complemento a partir de LCR.
El tratamiento de elecciû°n es el fluconazol a dosis de 5 mg/kg 2 veces dûÙa durante 3 o 4 meses para prevenir posibles recaûÙdas. Al igual que en las meningitis criptocû°cicas puede monitorizarse el tratamiento mediante sucesivas valoraciones de los tûÙtulos de anticuerpos, considerandose el ûˋxito terapûˋutico en el paciente canino cuando los tûÙtulos son inferiores a 1:4. En los gatos, los tûÙtulos pueden persistir elevados durante mucho tiempo a pesar de una terapia exitosa.
TOXOPLASMOSIS Y NEOSPOROSIS:
El Toxoplasma gondii y Neospora caninum son parûÀsitos coccidios pertenecientes al phylum Apicomplexa produciendo ambos una enfermedad y un patrû°n de LCR similares, razû°n por la que quedan incluidas en el mismo capûÙtulo. El huesped definitivo para el Toxoplasma es el gato, mientras que el perro es para Neospora. Toxoplasma infecta con mayor frecuencia el SNC del gato, aunque tambiûˋn puede aislarse del encûˋfalo del perro, mientras que neospora es mûÀs caracterûÙstico del SNC en el perro. Ambos parûÀsitos producen con frecuencia infecciones subclûÙnicas permaneciendo enquistados en el SNC u otros û°rganos durante aûÝos, o toda la vida del animal. El empleo de corticoterapias u otras situaciones inmunodepresoras pueden reactivar el parûÀsito desencadenando el proceso. Los animales jû°venes e inmunolû°gicamente inmaduros son mûÀs susceptibles de padecer la enfermedad, por lo que son los cachorros y gatitos, generalmente infectados por vûÙa transplacentaria, los que presentan la sintomatologûÙa mûÀs grave.
Los sûÙntomas en los cachorros incluyen parûÀlisis progresivas, con atrofia y contracturas de los mû¤sculos pelvianos. Los perros adultos manifiestan generalmente paraparesia, aunque pueden presentar convulsiones, alteraciones conductuales y disfunciû°n vestibular; ademûÀs de otras manifestaciones sistûˋmicas. Los gatos presentan ataxia, anormalidades conductuales, convulsiones y tremores.
Los resultados de la hematologûÙa y bioquûÙmicas dependen de los û°rganos afectados, aunque suelen ser inespecûÙficas. El diagnû°stico se establece por tests inmunolû°gicos como ELISA o IFI a partir de suero o LCR, siendo factible calcular el coeficiente IgG C especûÙfico (explicado anteriormente), con el objeto de intentar demostrar la producciû°n intratecal de inmunoglobulinas especûÙficas. A pesar de que el cûÀlculo de IgG C especûÙfico es probablemente el mejor mûˋtodo incruento disponible en la actualidad para el diagnû°stico de infecciû°n en SNC, el û¤nico mûˋtodo de diagnû°stico definitivo es la observaciû°n directa del parûÀsito en un corte histolû°gico a partir de un tejido biopsiado.
El LCR muestra a menudo una pleocitosis mononuclear leve a moderada (con predominio de linfocitos) y valores generalmente menores de 20 % de neutrû°filos. Es caracterûÙstico un aumento leve de proteûÙnas, aunque los valores obtenidos pueden ser normales. Es relativamente frecuente observar valores entre 5 y 10% de eosinû°filos, aunque han sido descritos casos con valores superiores. Son raras las ocasiones en las que puede observarse el parûÀsito en los preparados citologicos del LCR.
El tratamiento se realiza con clindamicina a dosis de 10-20 mg/kg vûÙa oral, 3 veces dûÙa y un mûÙnimo de 4 semanas. Un tratamiento precoz resuelve habitualmente los sûÙntomas en 1 o 2 semanas, aunque los animales con hiperextensiû°n de los miembros pelvianos tienen peor pronû°stico.
ENFERMEDADES RICKETSIALES:
1 - Ehrlichiosis canina:
La ehrlichiosis canina es una enfermedad cosmopolita, que puede ser producida por varias especies de Ehrlichia, aunque es con mucho la Ehrlichia canis la especie que infecta al perro con mûÀs frecuencia. La E. canis se transmite por la garrapata Rhipicephalus sanguineus y se multiplica en las cûˋlulas mononucleares, distribuyûˋndose por todo el organismo y causando vasculitis e inflamaciû°n en organos internos y SNC. Es una enfermedad no estacional pudiendo producirse durante todo el aûÝo.
La sintomatologûÙa es bastante inespecûÙfica con astenia y pûˋrdida de peso. En un tercio de los animales afectados se desarrollan signos neurolû°gicos, con parûÀlisis, convulsiones y dolor espinal. Durante la exploraciû°n fûÙsica se puede manifestar palidez de mucosas, linfadenopatûÙas, petequias y signos oculares como uveitis o coriorretinitis. La enfermedad puede tener un curso agudo desde unos pocos dûÙas, a un curso crû°nico con una duraciû°n de varios meses. Son frecuentes las infecciones subclûÙnicas.
Los datos laboratoriales relacionados con el hemograma y bioquûÙmica sûˋrica, arrojan resultados tambiûˋn inespecûÙficos, siendo frecuentes una anemia leve o moderada, poco regenerativa, normocûÙtica y normocrû°mica; trombocitopenias tambiûˋn leves o moderadas y en algunas ocasiones tambiûˋn se manifiesta leucopenia. En algunos animales infectados se observan signos de anemias severas o muy severas y/o trombocitopenias graves, como consecuencia de desû°rdenes inmunomediados desencadenados por la Ehrlichia. Los signos bioquûÙmicos frecuentes incluyen hiperglobulinemia con hipoalbuminemia reactiva y elevaciû°n de enzimas hepûÀticas. La identificaciû°n de las mû°rulas caracterûÙsticas en las cûˋlulas mononucleares (o en los neutrû°filos en caso de infecciû°n por E. ewingii) a partir de sangre perifûˋrica es poco frecuente, aunque diagnû°stica de la infecciû°n, ya que la bacteriemia se presenta en fases tempranas de la enfermedad, y a menudo las mû°rulas desaparecen al inicio de la sintomatologûÙa. La sensibilidad del procedimiento aumenta a partir de muestras de mûˋdula û°sea, ganglio lûÙnfûÀtico o tejido esplûˋnico. Asimismo, es recomendable realizar la extensiû°n de sangre perifûˋrica a partir de un concentrado de leucocitos recogido de la capa flogûÙstica. El diagnû°stico serolû°gico se realiza mediante inmunofluorescencia indirecta (IFI). TûÙtulos de anticuerpos > a 1:20 se consideran diagnû°sticos de la enfermedad si los pacientes presentan sintomatologûÙa compatible. Asimismo, la detecciû°n de anticuerpos anti-Ehrlichia canis en LCR es diagnû°stico de la enfermedad, si se excluye la posibilidad de alteraciones funcionales en la barrera hematoencefûÀlica.
Son escasos los artûÙculos que describen el patrû°n obtenido del anûÀlisis del LCR en las enfermedades ricketsiales en general, pero probablemente sean variables, dependiendo del grado de compromiso neurolû°gico de la enfermedad. Los animales infectados con Ehrlichia canis con afectaciû°n neurolû°gica muestran un patrû°n similar al obtenido con infecciones vûÙricas. Se observa pleocitosis mononuclear, generalmente moderada (RTCN = 30-100 cels/microL) con mûÀs de un 80 % de cûˋlulas mononucleares. Las proteûÙnas totales tienen con frecuencia incrementos leves o moderados.
El tratamiento se realiza con propionato de imidocarb y con antibiû°ticos. Algunos autores recomiendan la administraciû°n de propionato de imidocarb a dosis de 5 mg/kg intramuscular en dos tomas por espacio de 15 dûÙas y dosiciclina a 10 mg/kg, 2 veces dûÙa, durante 3 semanas. La corticoterapia es û¤til ante anemias o trombocitopenia severas sospechosas de origen inmunomediado o ante signos neurolû°gicos. En tales casos se recomienda la administraciû°n de dosis inmunosupresoras de corticoides a corto plazo (durante 8 o 10 dûÙas, para ir disminuyendo progresivamene la dosis).
2 - Fiebre maculosa de las montaûÝas rocosas:
La fiebre maculosa de las montaûÝas rocosas es una enfermedad canina de curso agudo y endûˋmica en algunas regiones de amûˋrica, producida por Rickettsia rickettsii y transmitido por garrapatas. Las rickettsias parasitan las cûˋlulas endoteliales produciendo vasculitis necrotizante en numerosos û°rganos. A diferencia de Ehrlichia canis, es una enfermedad estacional, produciûˋndose con mayor frecuencia durante los meses de primavera y verano.
Los signos clûÙnicos son similares a la ehrlichiosis canina con fiebre, debilidad y anorexia. En ocasiones se desarrollan hemorragias petequiales. Aproximadamente, el tercio de los animales afectados presenta signos neurolû°gicos con convulsiones, ataxia y disfunciû°n vestibular. Algunos animales enferman de gravedad produciûˋndose la muerte en 2-3 semanas, si no se administra tratamiento.
El hemograma y bioquûÙmica pueden revelar neutrofilia, trombopenia e hipoalbuminemia. El anûÀlisis de LCR de animales con afectaciû°n neurolû°gica, muestra en muchas ocasiones un patrû°n normal, y cuando se presentan alteraciones suelen ser leves con pleocitosis neutrofûÙlica (los RTCN no suelen sobrepasar las 60 cûˋlulas/microL, aunque en algunos casos excepcionales pueden duplicar el recuento). Los aumentos de proteûÙna tambiûˋn suelen ser leves no superando los 80 mg/dL.
El tratamiento se realiza con la administraciû°n de tetraciclinas, doxiciclina, enrofloxacina o cloranfenicol. El pronû°stico es bueno si la antibioterapia se emplea en fases tempranas de la enfermedad. Pueden presentarse secuelas si hay lesiones neurolû°gicas irreversibles.
ENFERMEDADES PARASITARIAS:
Tanto los perros como los gatos pueden resultar afectados por migraciones aberrantes del SNC de formas larvarias de cuterebra. Esta miasis es mûÀs frecuente en gatos. Las larvas voladoras se adhieren a la piel y cavando hacia el tejido subcutûÀneo pueden migrar hasta el encûˋfalo. Otra vûÙa de entrada, posiblemente mûÀs frecuente, es por las fosas nasales atravesando la lûÀmina cribiforme. La sintomatologûÙa mûÀs comû¤n incluye convulsiones, anormalidades conductuales, marcha circular, ceguera, hemiparesia y depresiû°n. Los signos neurolû°gicos, a menudo van precedidos por estornudos o epistaxis (larvas en vûÙas nasales).
El anûÀlisis del LCR puede ser normal o mostrar una leve hiperproteinorraquia y leve pleocitosis con predominio de cûˋlulas mononucleares o eosinû°filos. Las lesiones observadas en RMN son hipointensas en T1 e hiperintensas en T2.
El tratamiento se realiza con anticonvulsionantes y antibiû°ticos. Algunos autores han propuesto un tratamiento especûÙfico con difenhidramina a 4 mg/kg via IM, e ivermectina (400 microgr/kg, vûÙa subcutûÀnea) y dexametasona (0,1 mg/kg, IV).
|